Почему вода такой хороший растворитель? Простейшее объяснение
Стоит бросить щепотку соли в воду, и она растворится за секунды. Но если капнуть масло — оно останется плавать. Почему вода ведет себя так избирательно? Секрет в полярности.

Молекула воды (H2O) — это крошечный "магнит". Кислород тянет электроны на себя сильнее, чем водород, поэтому у него появляется легкий отрицательный заряд, а у двух атомов водорода — положительный. Получается "электрический перекос": одна часть молекулы отрицательная, другая — положительная.
Эта асимметрия позволяет воде взаимодействовать с ионными соединениями и полярными молекулами — противоположно заряженные части молекулы воды притягиваются к разным ионам вещества, разрушая его структуру.
Как вода "ломает" соль
Соль (NaCl) — это соединение с кристаллической решеткой (ионной решеткой кубической формы) из положительного натрия (Na⁺) и отрицательного хлора (Cl⁻). Как только соль попадает в воду, сразу же запускается реакция:
- Отрицательная часть молекул воды (кислород) притягивается к Na⁺;
- Положительная часть (атомы водорода) — к Cl⁻;
- Решетка разрушается, ионы растаскиваются в разные стороны.
Молекулы воды буквально отрывают ионы друг от друга и формируют вокруг каждого гидратную оболочку — слой из нескольких молекул воды, повернутых к иону противоположно заряженной частью, что препятствует их воссоединению. Так разрушается кристаллическая решетка, и ионы равномерно распределяются в объеме раствора.
Схожим образом вода связывается с полярными молекулами вроде сахаров, спиртов и кислот, образуя водородные связи.
Почему масло не растворяется?
Молекулы жиров и масел неполярные, так как состоят из длинных углеводородных цепей, где электроны распределены равномерно (отсутствуют заряженные участки). А вода, являющаяся полярной, не способна взаимодействовать с такой электрически нейтральной структурой, потому что ей просто не за что "зацепиться".

Когда масло попадает в воду, то молекулы воды "игнорируют" его, продолжая образовывать водородные связи между собой. Масло быстро вытесняется и собирается в капли на поверхности. В природе существует четкое правило: полярное растворяет полярное, неполярное растворяет неполярное.
Именно поэтому для удаления жирных загрязнений используют моющие средства — они содержат молекулы с двойной природой (амфифильные), которые могут одновременно взаимодействовать и с водой, и с жирами. У таких молекул одна часть (гидрофильная "голова") полярная и любит воду, а другая (гидрофобный "хвост") неполярная и притягивается к жирам. Когда моющее средство попадает в воду с маслом, его молекулы окружают жировые капли хвостами внутрь, а головами наружу — образуются мицеллы.
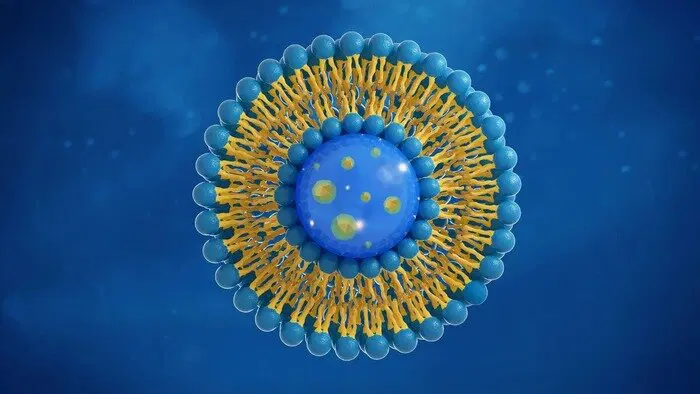
Таким образом капли жира обзаводятся полярными оболочками, позволяющими воде их "схватывать" и смывать.


Комментарии