Одобрены клинические испытания генетического лечения от гепатита B или как можно победить хронические вирусные заболевания
Всяких разных вирусов существует много: иммуннодефицита человека, вирусы папилломы, герпес-вирусы, гриппа и далее, и далее. Выбирай - не хочу. Классифицируются они сразу по нескольким системам, взаимодополняющим друг друга. Например, по тропности - способности заражать определённые типы клеток. Или по виду генетического материала: ДНК или РНК.
Одним из видов таких вот классификторов является внутриклеточная форма генетического материала вируса. Обычно вирусы представляют вот так:
Это нечто называется вирионом и представляют собой полноценную вирусную частицу, способную заражать клетки. Как только вирус попадает в клетку, его внешняя оболочка раскрывается, освобождая генетический материал в виде РНК или ДНК.
Дальше возможные следующие ситуации:
- ДНК вируса встраивается в ДНК клетки, образуя провирус;
- ДНК или РНК вируса остаётся в клетке в виде вирусной эписомы, встраивания не происходит;
- Комбинированный вариант, когда в ДНК клетки встаривается ДНК вируса (или её часть) , а в самой клетке дополнительно находится эписома.
Для борьбы с вирусами у организма есть несколько механизмов, однако они не совершенны. В некоторых случаях бывает так, что генетический материал вируса остаётся в клетке и не подавляется иммунной системой. Тогда инфекция становится хронической. Самые яркие примеры подобных вирусов - это ВИЧ, ВПЧ, герпес-вирусы, гепатиты B и С.
С гепатитом С человечество научилось бороться, а вот от всего остального излечения нет. Есть только поддерживающая терапия, которая позволяет прервать литический цикл (это когда ДНК или РНК вируса начинает штамповать новые вирионы).
Самым ярким примером, с которым знаком почти каждый, является вирус простого герпеса 1типа (ВПГ 1) . Тот самый, который обычно проявляется «простудой» на губах:
Когда складываются условия, эписома ВПГ 1 активируется. Можно подождать, а можно намазаться мазью или выпить таблетки с ацикловиром и всё пройдёт быстро. До следующего раза, потому что существующие лекарства не способны подавить эписому. Та надёжна укрыта в нервных клетках и только и ждёт своего времени:
Насколько опасны вирусы? Зависит от вида, но даже простенький вирус гриппа приводит к сотням тысячам госпитализаций и десяткам тысяч смертям в сезон в стране вроде США. ВПЧ или герпесы разного вида становятся причиной тяжёлых заболеваний, в том числе и онкологичеких. А вирусы гепатита или ВИЧ без лечения приведут к неизбежному трындецу.
В общем, было бы хорошо все эти вирусы из организма убрать. Увы, как и было сказано, наша собственная иммунная система на это не способна. Поэтому человечеству опять пришлось взять всё в свои руки. Как же избавиться от хронической вирусной инфекции?
Вариат первый, который сразу же приходит на ум: убить клетку, содержащую вирус. Так поступает наша собственная иммунная система.
Однако тут есть два препятствия. Во-первых, расточительно. Клеток у нас много, около 40 триллионов, но всё равно жалко. Кроме того, часть из этих клеток - это чувствительные нейроны, а их убивать очень не хочется.
Во-вторых, заражённые клетки тяжело распознать внутри организма. Вне литического цикла, когда вирус не размножается, заражённые клетки бывают и вовсе не отличимы от обычных с внешней стороны.
Кроме того, многие вирусы, хотя и предпочитают какой-то конкретный тип клеток, на деле заражают и множество других. Например, многие слышали, что ВИЧ поражает клетки иммунной системы, в первую очередь Т-лимфоциты. Однако, помимо них, ВИЧ создаёт вирусный резервуары в множестве других клетках и органах:
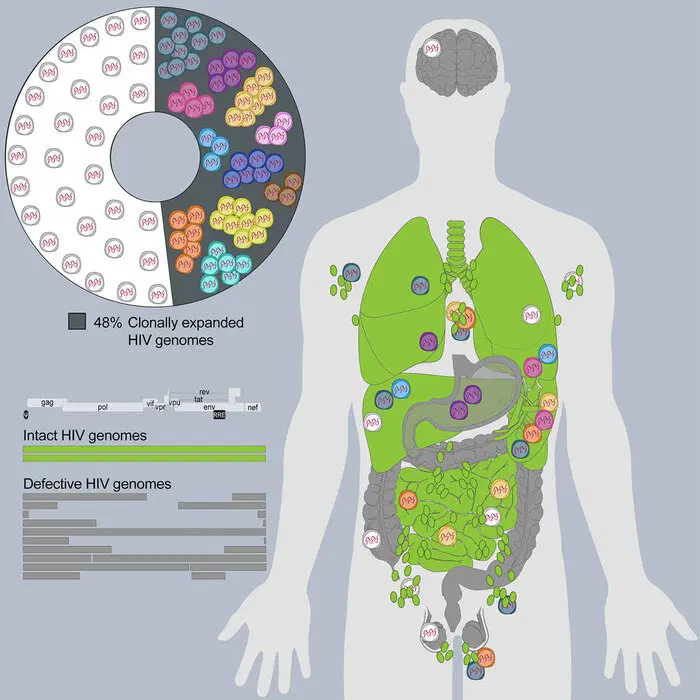
Каким-то образом их нужно выцепить, предварительно распознав. Задача нетривиальная, да и, как было сказано, такое количество клеток уничтожать жаль. Пригодятся ещё.
На деле уничтожить заражённые клетки пока настолько сложно, что человечество пошло другим путём. А именно, начало пытаться уничтожить провирусы и/или эписомы.
Лет 15 назад об этом можно было только мечтать, но сейчас всё изменилось. В 2013 году была впервые продемонстрирована технология генного редактирования CRISPR/Cas9. Благодаря ей у нас появилась возможность быстро и относительно дёшево (всего-то пара миллионов долларов за укол, мелочи) работать с ДНК.
CRISPR/Cas9 уже применяется для лечения нескольких наследственных заболеваний вроде бета-талассемии. И вот, пришло время попробовать забороть ею вирусы. Одним из плюсов генной терапии является то, что убивать клетку не нужно.
Бороться с вирусами с помощью CRISPR/Cas9 можно тремя путями.
- Первый и самый лучший: полностью вырезать из ДНК клетки провирус, а также развалить на части вирусную эписому. Только этот способ может гарантировать полное излечение.Когда-нибудь так и будет, но пока невозможно. Как мы уже говорили, вирусных резервуаров много и нужно уничтожить вирус во всех.К тому же, нынешние версии CRISPR/Cas9 обладают серьёзным недостатком в виде нецелевого редактирования. Помимо изменений в нужных участках ДНК, редактирование может произойти и в не нужных. Хотя ситуация эта редкая, может не повезти и задеть чувствительные участки генома. Так же есть проблемы со «склеиванием» после удаления фрагмента;
- Второй вариант, оптимальный на сегодняшний день. Провирус и эписома не вырезаются, зато ломаются. Если таких поломок в коде вируса будет достаточное количество, он перестанет функционировать. Новые вирионы собраться просто не смогут. Риски первого варианта заметно понижены;
- Третий, эпигенетический. Провирус и эписома остаются нетронутыми, но их активность заглушается. Почти во всех клетках человека одна и та же исходная ДНК, но в каждом типе клеток работает только её часть. Благодаря этому клетки печени работают как клетки печени, а не пытаются стать фибробластами.Достигается это при помощи процесса, называемого метилированием. В нужном участке ДНК к основанию присоединяется метильная метка, блокирующая или сильно подавляющая экспрессию гена. И вуаля — ген перестаёт работать, хотя из ДНК никуда не девается.
Именно последнюю идею взяли на вооружение в компании nChromaBio, решив забороть хронический гепатит B. Зачем напрягаться, если можно не напрягаться вырезать участки вируса, если можно сделать его неактивным?
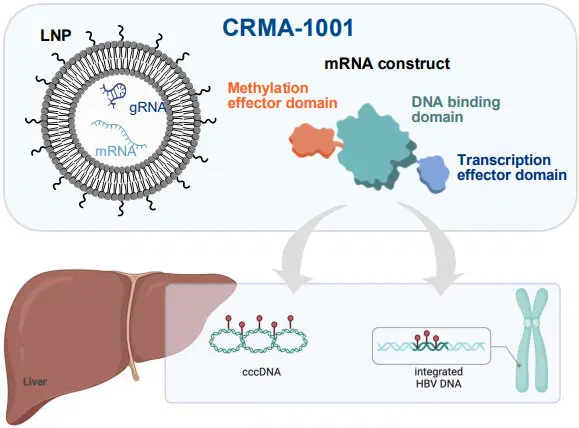
В основе технологии, используемой компанией, лежит dCas9. Этот фермент не может резать ДНК (как полноценный Cas9), но может найти нужное место и присоединить к нему молекулу. В данном случае молекулу, которая заглушит гены гепатита B.
Вирус гепатита В — один из вирусов, который существует в клетке в виде эписомы. Причём его ДНК скручивается в кольцо, да ещё и ковалентно связывается с другими подобными кольцами.
Помимо эписомы, вирус также внедряет в ДНК клетки человека часть своей ДНК. Внедрённая вирусная ДНК не способна произвести новый вирион гепатита В, но зато штампует вирусные белки. Для здоровья белки эти совсем не полезны и могут приводить к разным мутациям.
Идея проста и изящна: напихать стоп-сигналов во все участки вируса:
Испытания проводились на мышках и на обезьянах. Подопытным вводилась как единоразовая доза, так и несколько доз. Активность вируса оценивалась по продукции белка HBsAg (поверхностный антиген вируса гепатита В) и с помощью биопсии.
Результаты оказались впечатляющи. Во-первых, не было обнаружено не целевого метелирования, а сама ДНК осталась без повреждений. Во-вторых, удалось эффективно подавить как интегрированную часть ДНК, так и кольцевую. Насколько долго — пока не понятно, но за более чем полгода активность не возвратилась на исходный уровень.
Самое главное — есть ли функциональное излечение? Это зависело от дозы и способа ввода препарата. Чем выше была доза — тем больше подавлялся вирус. Если препарат вводили в небольшой дозе, но несколько раз — вирус с каждым разом подавлялся всё больше и больше.
По итогу, при оптимальном введение, удалось понизить вирусную нагрузку в десять тысяч раз. У 5 из 6 животных поверхностный антиген HBsAg больше не определялся:
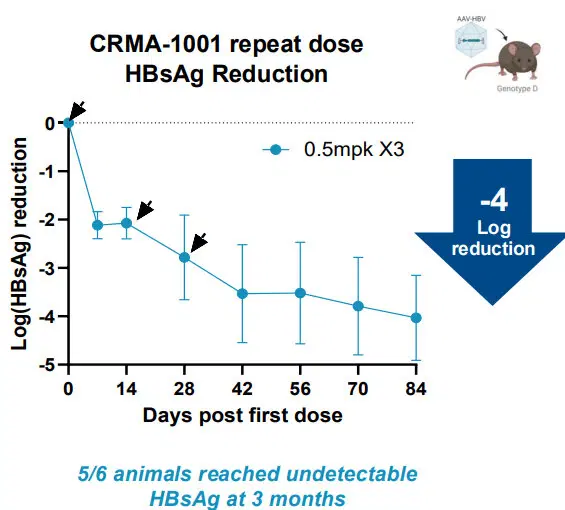
Подобный результат означает, что вирус более не активен.
Минус эпигенетического подхода обратная сторона плюсов. Да, ДНК при таком способе остаётся целой, но целыми остаются и вирус. Метильные метки достаточно стабильны, но со временем могут слетать. Учитывая, что речь идёт о хроническом заболевании, подобный подход может потребовать периодического повторения лечения.
Ну а nChromaBio прямо с 1 января 2026 года берётся за дело и начинает клинические испытания 1-2 фазы. В них примут участие 66 пациентов с хроническим гепатитом В. Всем им будет вводиться препарат в разных дозировках, а затем оцениваться состояние, как в краткосрочной перспективе (6 месяцев), так и в долгосрочной (5 лет).
P.S. Ещё у меня есть бессмысленные и беспощадные ТГ-каналы (ну а как без них?):
Вот тут про молекулярную биологию, медицину и новые исследования: https://t.me/nextmedi;
Мой личный, куда сваливается наука и всякое гиковское: https://t.me/deeplabscience.


Комментарии